Contenido |
|---|
Descripción:
13 cm. de longitud y 28 gramos de peso.
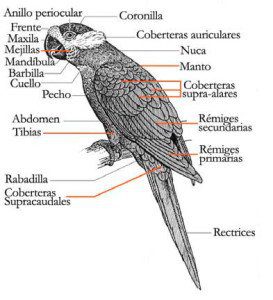
De apariencia rechoncha, la Cotorrita de Sclater (Forpus modestus) tiene la frente, lores, mejillas y corona, de color verde esmeralda, formando a veces una visible máscara; los lados y parte posterior del cuello, el manto, la parte superior de la espalda y los escapularios, más bien oscuros, de color verde mate con ligeros tintes de oliva; parte inferior de la espalda y grupa de color azul cobalto oscuro: coberteras supracaudales de color verde oscuro. Primarias y mayores cubiertas, de color azul oscuro. Primarias con redes internas verdes; Secundarias de color azul oscuro con puntas verdes. Bajo las alas de color azul cobalto oscuro; plumas de vuelo gris azulado. Partes inferiores opacas de color verde oscuro con un ligero matiz de oliva. Por arriba, la cola de color verde oscuro; por abajo, más pálida.
Mandíbula superior y cere de color gris oscuro, mandíbula inferior más clara; estrecho anillo perioptálmico de color gris oscuro; Iris marrón oscuro; patas grises.
Hembra toda verde excepto amarillento en la frente y zona frontal de la corona, contrastando con el verde más oscuro sobre la parte trasera de la corona.
Inmaduros como sus respectivo adulto pero más pálidos.
- Sonido de la Cotorrita de Sclater.
Descripción subespecies:
-
Forpus modestus modestus
(Cabanis, 1849) – La nominal.
-
Forpus modestus sclateri
(Gray,GR, 1859) – Similar a la especie nominal pero de un color verde más pálido, más amarillento debajo, macho con azul pálido en grupa y alas ; la cara verde esmeralda brillante.
Hábitat:
Habitan en bosque tropicales de tierras bajas en claros, márgenes, crecimiento ribereño, bosques de várzea, hábitats secundarios y sabanas, principalmente en tierras bajas (150-250 metros en Venezuela, a 500 metros en Colombia), pero extendiéndose en bosques subtropicales a 1.500-1.800m en los Andes orientales de Ecuador.
Gregario; Fuera de la temporada reproductiva a veces en bandadas de 100 o más individuos
Reproducción:
Anida en huecos de árboles muertos. Época de cría de ha registrado en el mes de julio en Perú.
Alimentación:
La dieta comprende semillas (por ejemplo, Cecropia miparia), bayas, yemas, etc. Toma suelo mineral de las riberas junto a otros loros.
Distribución:
Distribución de tamaño (reproducción / residente): 2.840.000 km2
Distribución discontinua. Desde las Guayanas al norte de Bolivia. Aunque según informes en Guyana y la Guayana Francesa no hay registros (al menos no recientemente). Se distribuyen por la cuenca amazónica oriental de Brasil en Amapá, Maranháo y Pará, y en la cuenca amazónica occidental desde el alto del Río Negro hasta el norte de Mato Grosso; en Venezuela, al sur del Orinoco, en el bajo Río Caura y Río Cuyuni (un registro de Carabobo; en el norte, está aparentemente equivocado); En el este de Colombia hacia el sur desde el extremo sureste de la Guainía (sobre el Río Negro) hasta Caquetá hacia el este de Ecuador y el este de Perú hacia el sur y hasta el norte de Bolivia hasta al menos Beni.
Razonablemente frecuentes en el oeste de su área de distribución (el Forpus más común en el rango en Ecuador y Colombia) pero más escaso hacia el este, con pocos registros en Venezuela y Guyanas.
Evidencia de declive en la Amazonia oriental (alrededor de Belém) y posible incremento en Colombia, quizás vinculada a la reducción de bosques densos.
Rara en cautiverio.
Distribución subespecies:
-
Forpus modestus modestus
(Cabanis, 1849) – La nominal.
-
Forpus modestus sclateri
(Gray,GR, 1859) – Sureste de Colombia al norte de Bolivia y la Amazonia brasileña.
Conservación:
Estado de conservación ⓘ |
||
|---|---|---|
 Preocupación menor ⓘ
(UICN)ⓘ
Preocupación menor ⓘ
(UICN)ⓘ
| ||
• Categoría de la Lista Roja: Menor preocupación
• Tendencia de la población: Estable
Justificación de la población:
El tamaño de la población mundial de la Cotorrita de Sclater no se ha cuantificado, pero esta especie se describe como «bastante común» (Stotz et al., 1996).
Justificación de tendencia:
Se sospecha que esta especie ha perdido 11,6-12,6% de hábitat adecuado dentro de su distribución en tres generaciones (12 años) basada en un modelo de deforestación amazónica (Soares-Filho et al., 2006, Bird et al., 2011).
Dada la susceptibilidad de la especie a la caza y/o la captura, se sospecha que disminuirá en <25% durante tres generaciones.
"Cotorrita de Sclater" en cautividad:
En cautividad no del todo conocida, sin embargo, esta especie es probablemente similar a otras especies de pericos – bastante tranquilo, mejor con un compañero, aunque, pueden ser agresivas con otros grupos de loritos. Tiene tendencia a la obesidad.
Pueden aprender a hablar, normalmente hasta alrededor de 15 palabras. Los machos son generalmente más locuaces que las hembras. También pueden aprender a silbar numerosas melodías y realizar algunos trucos.
Debido a que esta Cotorrita es muy pequeña, no ocupan mucho espacio, hace de ella una mascota ideal para personas que viven en apartamentos, residencias, o cualquier otro lugar que de pequeño tamaño, ya que no requieren una gran jaula y su mantenimiento es sencillo.
Nombres alternativos:
– Dusky-billed Parrotlet, Dusky billed Parrotlet, Sclater’s Parrotlet (inglés).
– Toui de Sclater (francés).
– Schwarzschnabel-Sperlingspapagei (alemán).
– tuim-de-bico-escuro (portugués).
– Catita Enana Oscura, Cotorrita de Sclater, Periquito Piquinegro (español).
– Periquito Piquinegro (Colombia).
– Periquito de Pico Oscuro (Perú).
– Periquito Pico Oscuro (Venezuela).
Clasificación científica:

– Orden: Psittaciformes
– Familia: Psittacidae
– Genus: Forpus
– Nombre científico: Forpus modestus
– Citation: (Cabanis, 1849)
– Protónimo: Psittacula Sclateri
Imágenes Cotorrita de Sclater:
Videos de la "Cotorrita de Sclater"
Cotorrita de Sclater (Forpus modestus)
Fuentes:
– Avibase
– Parrots of the World – Forshaw Joseph M
– Parrots A Guide to the Parrots of the World – Tony Juniper & Mike Par
– Birdlife
– Fotos:
(1) – Brazilië – Rio Cristalino (Amazonia)
(2) – Periquito de pico oscuro en Alta Floresta – MT – Brasil By Hector Bottai (Own work) [CC BY-SA 3.0], via Wikimedia Commons
(3) – Periquito de pico oscuro en Alta Floresta – MT – Brasil By Hector Bottai (Own work) [CC BY-SA 3.0], via Wikimedia Commons
(4) – Forpus modestus by Günther Eichhorn – Flickr
(5) – Dusky Billed Parrotlets at the end of the branch with Dusky Headed Parrots by Vince Smith – Flickr
(6) – Psittacula sclateri = Forpus modestus, Dusky-billed Parrotlet by John Gerrard Keulemans [Public domain], via Wikimedia Commons
– Sonidos: (xeno-canto)